STTT:北京大学詹启敏团队揭示食管鳞癌治疗新策略!
代谢异常被认为是与肿瘤进展和治疗抵抗相关的致癌标志。
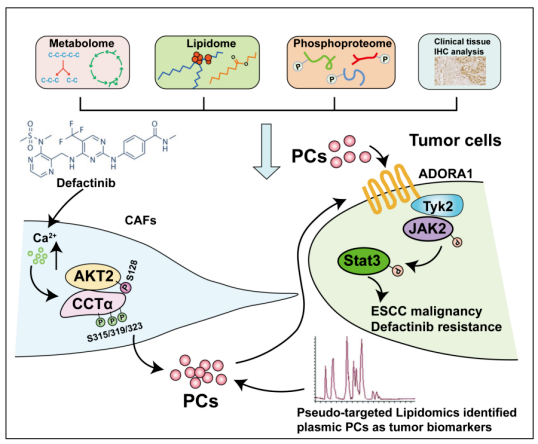
2024年1月28日,北京大学詹启敏团队在Signal Transduction and Targeted Therapy(IF=39)在线发表题为“AKT2S128/CCTαS315/319/323-positive cancer-associated fibroblasts (CAFs) mediate focal adhesion kinase (FAK) inhibitors resistance via secreting phosphatidylcholines (PCs)”的研究论文,该研究证明pAKT2 Ser128和pCCTα Ser315 /319/323阳性的癌症相关成纤维细胞(CAFs)大量释放磷脂酰胆碱(PCs),促进了局灶黏着激酶(FAK)抑制剂在食管鳞状细胞癌(ESCC)治疗中的耐药性。此外,观察到FAK Tyr397在CAFs中的表达水平极低,这可能为FAK抑制剂在CAFs中发挥其抗生长作用提供了潜在的靶点。
因此,FAK抑制剂增加了CAFs中细胞内Ca2+浓度,促进AKT2/CCTα复合物的形成,导致CCTα Ser315/319/323位点的磷酸化,最终促进间质PC的产生。这种激活可以刺激瘤内Janus kinase 2 (JAK2)/Signal transducer and activator of transcription 3 (STAT3)通路,触发对FAK抑制的抗性。临床样本分析表明基质pAKT2 Ser128和pCCTα Ser315/319/323与肿瘤恶性和患者生存率降低有关。非靶向脂质组学和进一步的验证队列定量显示血浆PCs能够区分ESCC患者的恶性程度。综上所述,抑制基质源性PCs及其相关通路可能是治疗肿瘤的一种可行的治疗策略。

食管鳞状细胞癌(ESCC)患者的预后很差,5年生存率不到15%。多种危险因素,如烟酒成瘾、遗传缺陷以及其他一些有害的环境因素都可能诱发ESCC的形成和发展。重要的是,低存活率是由于缺乏细胞毒性、靶向性和免疫治疗的治疗效果。对ESCC进行多组学综合分析将获得精确的分子分类,探索新的诊断标志物和治疗靶点,从而提高ESCC的治疗效果。相应地,探索信号成瘾、易损或其他一些重要的肿瘤相关通路,并评估其靶向性和可药物性,可以为ESCC的精确治疗提供研究范式。治疗耐药的关键机制是肿瘤微环境(TME)周围的ESCC细胞,特别是其主要成分-癌症相关成纤维细胞(CAFs)。CAFs在实体肿瘤的TME中发挥核心作用,诱导肿瘤的各种恶性表型,包括持续生长、侵袭转移、血管生成、上皮-间充质转化(epithelial-mesenchymal transition, EMT)和肿瘤干细胞的形成。
具体来说,ESCC与其周围CAFs之间的串扰通过细胞间接触、细胞因子释放和外泌体传播对肿瘤细胞的生物学行为产生重要影响。然而,CAFs衍生的代谢物,作为重要的信号介质,对肿瘤细胞的生物学作用有影响。代谢物及其相关中间体的改变有效地重新连接肿瘤细胞和TME的细胞成分,以促进脂质、蛋白质、葡萄糖和其他重要代谢相关途径的输出。此外,肿瘤细胞及其周围TME中关键代谢酶的表达改变或基因突变可显著提高肿瘤细胞和TME中代谢物的浓度,从而重塑TME,重编程肿瘤细胞,支持肿瘤恶性发展,诱导化疗耐药。肿瘤细胞如何利用代谢营养物质及其影响的信号通路是重点研究的领域。
机理模式图。图自:Signal Transduction and Targeted Therapy
肿瘤促进激酶的活性失调一直是人们关注的焦点,因为肿瘤细胞可以利用这些蛋白增强肿瘤细胞/TME的相互作用,从而逃避免疫监视,诱导肿瘤细胞的恶性进展或转移。激酶靶点的选择、抗肿瘤疗效的评价及相关分子机制是开发抗肿瘤药物的关键。局灶黏附激酶(Focal adhesion kinase, FAK)是细胞质中的非受体蛋白酪氨酸激酶,在细胞中普遍表达。大量研究表明,FAK在几种类型的实体肿瘤中的过表达有助于肿瘤恶性,并在将TME衍生的信号传递到肿瘤细胞中发挥纽带作用。在肿瘤细胞自身及TME细胞组分的信号刺激下,瘤内FAK可通过其激酶依赖功能促进肿瘤细胞的许多细胞或生物活动或反应,或作为支架蛋白影响几种蛋白信号体的组装,从而促进肿瘤细胞的不可控生长和持续侵袭转移。这些发现有助于开发用于肿瘤临床治疗的FAK抑制剂。
许多I期或II期临床试验已被批准或进行,以观察FAK抑制剂单独或与其他抗肿瘤药物联合治疗肿瘤的疗效。总之,结合多组学,该研究系统地研究了特定CAFs亚群与肿瘤细胞之间基于pc的旁分泌通讯,以限制FAK抑制剂的抗肿瘤功效。在机制上,CAFs衍生的AKT2/CCTα轴及其激活的瘤内JAK2/STAT3通路的改变诱导FAK抑制剂在肿瘤治疗中的耐药性。重要的是,PCs可能被用作ESCC诊断的新生物标志物。这些数据为针对代谢物相关途径治疗ESCC提供了一种新的策略。
来源:iNature
-
生物医药领域要点速览

生物医药领域要点速览
-
Cell Res:把肝癌变成“慢病”!厦门大学林圣彩等团队发现“辟谷精”为肝癌治

Cell Res:把肝癌变成“慢病”!厦门大学林圣彩等团队发现“辟谷精”为肝癌治
-
Nature全新子刊—Nature Hearth,上线首篇论文!

Nature全新子刊—Nature Hearth,上线首篇论文!
-
《科学》:癌细胞喜欢“酸”的原因找到了!这种环境让肿瘤生长更猛烈!

《科学》:癌细胞喜欢“酸”的原因找到了!这种环境让肿瘤生长更猛烈!
-
CRM:这思路,绝了!中国医大/浙大/复旦团队,将中性粒细胞变成“顺风车”,搭载

CRM:这思路,绝了!中国医大/浙大/复旦团队,将中性粒细胞变成“顺风车”,搭载