铁死亡 | 北京大学王崑等团队研究揭示LncRNA-HMG通过抑制p53介导的铁死亡刺激结直肠癌细胞产生化疗耐药! !

化疗时,过多的活性氧(ROS)常导致癌细胞产生大量的脂质过氧化物,诱发细胞死亡,即铁死亡。ROS的消除是肿瘤细胞摆脱铁死亡并获得耐药性的关键。然而,长链非编码RNA (lncRNAs)在ROS代谢和肿瘤耐药中的确切功能尚不清楚。
2024年9月18日,北京大学王崑及刘小锋共同通讯在Redox Biology在线发表题为“LncRNA-HMG incites colorectal cancer cells to chemoresistance via repressing p53-mediated ferroptosis”的研究论文,该研究表明LncRNA-HMG促进结直肠癌化疗耐药,可能是结直肠癌的预后或治疗靶点。
研究通过高通量筛选发现lncRNA-HMG是结直肠癌(CRC)中与化疗耐药相关的lncRNA。LncRNA-HMG异常高表达预示结直肠癌患者预后较差。同时,研究发现LncRNA-HMG在化疗时保护CRC细胞免于铁死亡,从而增强CRC细胞的耐药性。LncRNA-HMG结合p53并促进MDM2介导的p53降解。p53的降低诱导SLC7A11和VKORC1L1的上调,从而增加还原剂的供应,消除过多的ROS。因此,结直肠癌细胞逃避铁下垂并获得化疗耐药性。重要的是,在患者来源的异种移植(PDX)模型中,反义寡核苷酸(ASO)抑制LncRNA-HMG显著使CRC细胞对化疗敏感。LncRNA-HMG也是β-catenin/TCF的转录靶点,激活的Wnt信号触发LncRNA-HMG的显著上调。

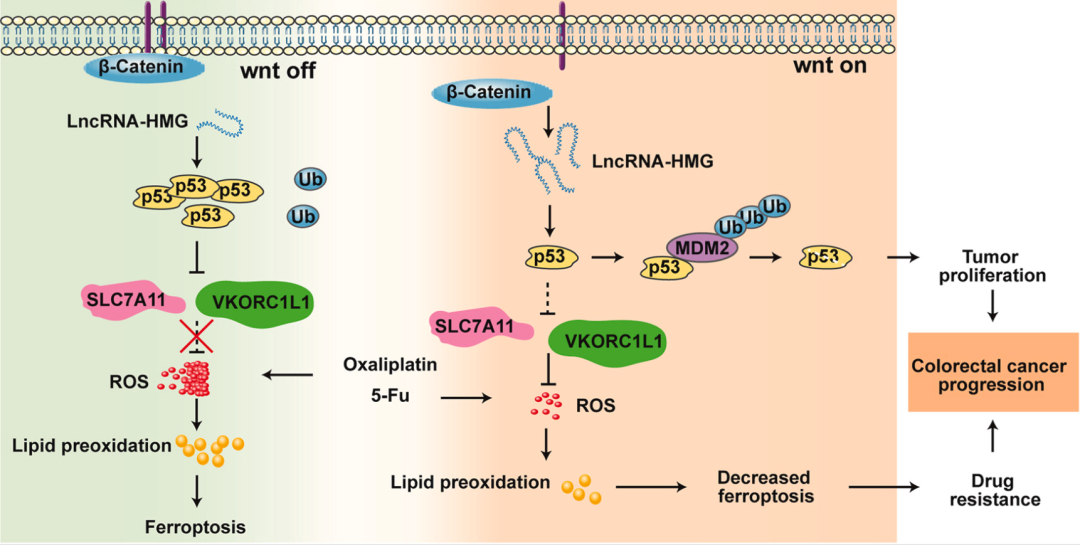
图形摘要。图自:Redox Biology
长链非编码RNA (lncRNAs)是指长度超过200个核苷酸的非编码RNA转录本。近年来,大量研究报道lncRNAs与肿瘤发生、肿瘤进展密切相关,如癌细胞生长、转移、耐药等。靶向lncRNAs显示出开发癌症治疗新策略的潜力,例如通过小干扰RNA (siRNA)、反义寡核苷酸(ASOs)或CRISPR/Cas9系统抑制lncRNAs。据报道,一些lncRNA参与调节肿瘤代谢。然而,在结直肠癌化疗中,lncRNAs在调节p53介导的代谢适应以平衡ROS水平中的作用尚不清楚。
研究发现LncRNA-HMG加重了结直肠癌的化疗耐药。机制上,LncRNA-HMG由Wnt/β-catenin信号诱导,破坏p53介导的转录抑制,消除ROS和脂质过氧化物,从而抑制铁死亡。这些发现揭示了LncRNA-HMG在结直肠癌化疗耐药中的关键作用,并暗示其作为结直肠癌治疗靶点的潜在价值。
来源:iNature
-
生物医药领域要点速览

生物医药领域要点速览
-
Cell Res:把肝癌变成“慢病”!厦门大学林圣彩等团队发现“辟谷精”为肝癌治

Cell Res:把肝癌变成“慢病”!厦门大学林圣彩等团队发现“辟谷精”为肝癌治
-
Nature全新子刊—Nature Hearth,上线首篇论文!

Nature全新子刊—Nature Hearth,上线首篇论文!
-
《科学》:癌细胞喜欢“酸”的原因找到了!这种环境让肿瘤生长更猛烈!

《科学》:癌细胞喜欢“酸”的原因找到了!这种环境让肿瘤生长更猛烈!
-
CRM:这思路,绝了!中国医大/浙大/复旦团队,将中性粒细胞变成“顺风车”,搭载

CRM:这思路,绝了!中国医大/浙大/复旦团队,将中性粒细胞变成“顺风车”,搭载