基因编辑 | | 徐州医科大学安述明等团队合作发现导致社交缺陷和睡眠不足的调控新机制! !

自闭症谱系障碍(ASD)患者经常会出现睡眠障碍。神经胶质蛋白3(NLG3)基因的遗传突变与ASD和睡眠障碍高度相关。然而,这种相关性的细胞和神经回路基础仍然难以捉摸。
2024年7月26日,徐州医科大学安述明、曹君利、孙海艳和东南大学谢维共同通讯在 Journal Of Clinical Investigation 在线发表题为“Autism-associated neuroligin-3 deficiency in medial septum causes social deficits and sleep loss in mice”的研究论文。该研究发现内侧隔膜(MS)中的NLG3(NLG3-CKO)的条件性敲除会损害社交记忆并减少睡眠。MS中的NLG3敲除会导致MS-GABA神经元在社交回避和清醒期间过度活跃。MSGABA神经元的激活会导致C57BL/6小鼠的社交记忆缺陷和睡眠不足。相反,这些神经元的失活会改善NLG3-CKO小鼠的社交记忆缺陷和睡眠不足。
睡眠不足会导致社交记忆缺陷,而社交隔离会导致睡眠不足,两者都会导致C57BL/6小鼠的MS中NLG3表达减少和GABAergic神经元活动增加。此外,MS-GABA支配的CA2神经元特异性地调节社交记忆而不影响睡眠,而MSGABA支配的视前区神经元选择性地控制睡眠而不影响社交行为。总之,这些发现表明,过度活跃的MS-GABA神经元会损害社交记忆并扰乱MS中NLG3敲除所导致的睡眠,并通过其不同的下游靶点实现模态特异性。

临床上,多达80%的自闭症谱系障碍(ASD)患者患有睡眠障碍。ASD和睡眠障碍之间的这种关系是双向的,这意味着睡眠问题的恶化会加剧ASD的核心症状,反之亦然。具体而言,睡眠不足会导致人类的社交退缩和啮齿动物的社交记忆缺陷。另一方面,长期的社会隔离已被证明会导致苍蝇、啮齿动物和人类的睡眠障碍。然而,这种关系背后的神经回路机制仍然不太清楚,阻碍了有效的临床干预措施的进展。内侧隔膜(MS)不仅参与调节社会记忆,还参与睡眠-觉醒调节。值得注意的是,MS神经元的化学遗传操控可以双向调节社会记忆。同时,操控MS谷氨酸能神经元可以双向调节睡眠-觉醒。这引发了一个问题:尽管这两个过程属于两种不同的生理模式,但相同的MS神经元是否同时调节社会记忆和睡眠。
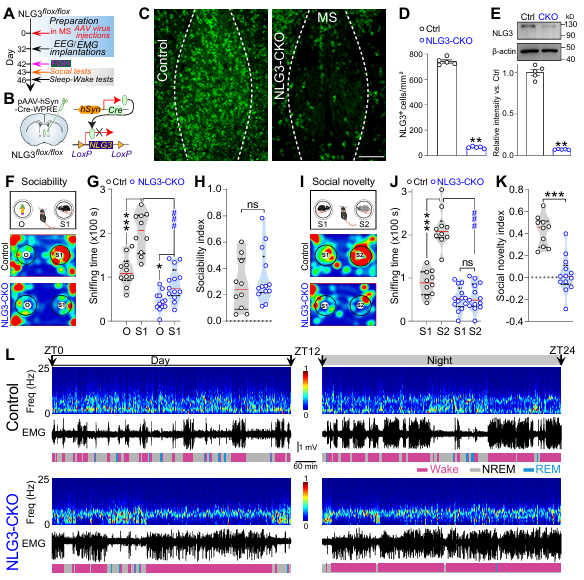
多发性硬化症中NLG3的条件性敲除会损害社交记忆并减少睡眠。图自 :Journal Of Clinical Investigation
神经胶质蛋白3(NLG3)是一种位于突触后的细胞粘附分子,在突触形成和突触传递中发挥作用。完全敲除NLG3的小鼠表现出社交记忆障碍,与自闭症患者的症状相似。此外,敲除NLG3的大鼠表现出非快速眼动(NREM)睡眠时间缩短。然而,尚不确定MS中条件性敲除NLG3(NLG3-CKO)是否会导致社交和睡眠行为受损。当前的研究旨在研究MS中NLG3条件性敲除后MS神经元的过度活跃如何通过不同的下游电路靶点导致睡眠和社交障碍。通过结合光极记录、病毒追踪、荧光原位杂交(FISH)和光遗传学操作,在NLG3-CKO小鼠中检测到了双重编码集合(MSGABA神经元)。这些神经元在社交回避或清醒时表现出过度活跃。MSGABA神经元的激活会损害社交记忆并减少NREM睡眠,而这些神经元的失活会改善社交记忆和NREM睡眠的缺陷。睡眠剥夺和社会隔离都会降低NLG3表达并增加MSGABA神经元活动。进一步确定,CA2神经元接收来自MSGABA神经元的输入,专门调节社交记忆而不影响睡眠,而视前区MSGABA支配的神经元则选择性地调节睡眠而不影响社交行为。这些结果表明,MSGABA神经元在MS中NLG3CKO后会损害社交记忆并扰乱睡眠,并通过其独特的下游投射实现社交记忆与睡眠的模态特异性。
来源:iNature
-
生物医药领域要点速览

生物医药领域要点速览
-
Cell Res:把肝癌变成“慢病”!厦门大学林圣彩等团队发现“辟谷精”为肝癌治

Cell Res:把肝癌变成“慢病”!厦门大学林圣彩等团队发现“辟谷精”为肝癌治
-
Nature全新子刊—Nature Hearth,上线首篇论文!

Nature全新子刊—Nature Hearth,上线首篇论文!
-
《科学》:癌细胞喜欢“酸”的原因找到了!这种环境让肿瘤生长更猛烈!

《科学》:癌细胞喜欢“酸”的原因找到了!这种环境让肿瘤生长更猛烈!
-
CRM:这思路,绝了!中国医大/浙大/复旦团队,将中性粒细胞变成“顺风车”,搭载

CRM:这思路,绝了!中国医大/浙大/复旦团队,将中性粒细胞变成“顺风车”,搭载