肿瘤免疫 | 西安交通大学何旺骁/闫瑾合作制备超分子白蛋白再激活肺腺癌中的适应性免疫应答! !

免疫检查点抑制剂(ICB)虽然延长了肺腺癌(LUAD)患者的生存期限,但其临床转化和长期有效性受到获得性耐药问题的阻碍。
2024年10月21日,西安交通大学何旺骁、闫瑾共同通讯在Small 在线发表题为“Rebooting the Adaptive Immune Response in Immunotherapy-Resistant Lung Adenocarcinoma Using a Supramolecular Albumin”的研究论文。该研究对免疫治疗耐药LUAD患者的生物信息学和抗PD1耐药小鼠模型进行了系统分析,再次验证了耐药相关的Wnt/β-catenin通路是增强ICB疗效的有效方法。
因此,作者开发了由白蛋白和鼠尾草酸(CA)(一种Wnt抑制剂)自组装形成的ABCA超分子白蛋白,作为ICB的再激活剂。正如预期的那样,体外实验中ABCA有效抑制了Wnt/β-catenin级联反应,在促进细胞凋亡的同时显著抑制细胞增殖。值得注意的是,免疫疗法耐受的LUAD原位同种异体移植小鼠模型中,ABCA通过重塑T淋巴细胞介导的适应性免疫反应,恢复了抗PD1的抗癌功效。此外,ABCA在治疗和高剂量毒性试验中表现出最小的副作用,具备临床转化的潜力。总体而言,该研究为解决免疫疗法耐药性问题提供了新视角,也为将Wnt抑制剂转化为免疫治疗药物,以实现临床应用提供了一种有效方法。


高度恶性肺腺癌(LUAD)是最普遍的组织学亚型,占非小细胞肺癌病例的三分之二以上,但手术后5年生存率低,靶向治疗失败后晚期化疗效果有限。免疫疗法的出现,尤其是PD-1/PD-L1免疫检查点抑制剂(ICB),彻底改变了晚期肺腺癌(LUAD)患者的状况并显著延长了患者生存期。然而,获得性耐药对患者的ICB治疗构成了严重威胁,5年生存率低于10%。越来越多的证据表明,免疫微环境在获得性免疫抵抗中起着至关重要的作用。一方面,PD-L1抑制剂耐药小鼠模型和晚期肿瘤复发患者中,根除或抑制有助于免疫治疗反应的免疫细胞效应物和癌基因的信号传导,破坏了正常的PD-L1表达,促进了耐药性的产生;另一方面, ICB抗性肿瘤中,多效应T细胞(如细胞毒性T淋巴细胞和新抗原特异性T细胞)难以活化,无法对ICB免疫疗法产生持续免疫反应。为克服上述障碍,出现了抗PD1/PD-L1与放疗、化疗、肿瘤疫苗或溶瘤病毒的组合疗法,以及多个免疫检查点的共抑制。上述方法虽在一定程度上增强了肿瘤细胞的根除效果,但肿瘤微环境中免疫调节的持续时间和范围有限,且会对周围正常细胞产生有害影响,带来异常炎症反应。精准医学专注于靶向特定的异常蛋白质,改善不利于免疫激活的免疫微环境,因而受到广泛关注。其中,β-catenin在肿瘤免疫逃避中起着关键作用,尤其是ICB耐药性方面,是Wnt通路的潜在靶标。已有研究表明,β-catenin过度激活与免疫抑制细胞因子的表达密切相关,各种β-catenin激活的肿瘤组织中树突状细胞和T细胞浸润减少,形成肿瘤免疫抗性微环境。该团队已经证明了Wnt/β-catenin信号转导抑制剂与免疫检查点阻滞剂(ICB)联合使用,可以诱导各种肿瘤模型的免疫治疗敏感性。考虑到全身免疫相关靶点引起的不良反应,免疫治疗增敏需要仔细考虑各种给药的时间和剂量比。此外,也存在肿瘤积累不足和多重副作用的问题。虽然Wnt/β-catenin靶向抑制剂是改善ICB耐药的潜在药物,但尚未批准任何专门规避或逆转获得性ICB耐药的临床药物。
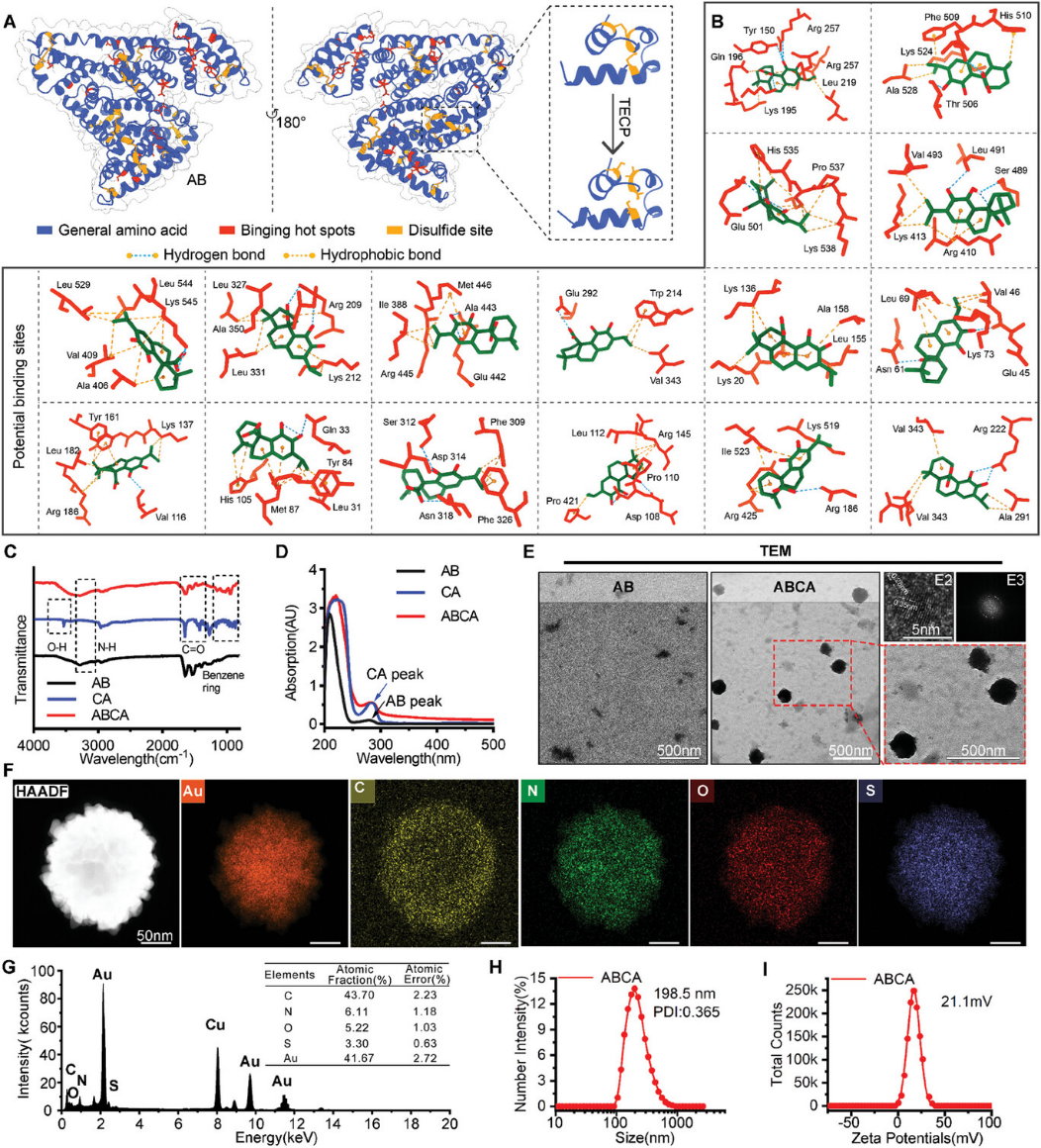
图1 ABCA的制备和表征(摘自Small )
该团队之前报道了一种小分子化合物鼠尾草酸(CA)作为Wnt/β-catenin信号通路中β-catenin的特异性抑制剂,其直接结合并破坏β-catenin的犰狳重复结构域结构域中的H1螺旋,从而诱导β-catenin寡聚化和降解。为增强治疗剂的肿瘤特异性,已经开发了多种高效的纳米药物来优化肿瘤内的分子富集并确保其安全循环,但仍存在纳米颗粒降解不充分、化合物负载不足以及组装过程复杂等问题。因此,作者通过白蛋白和CA之间的自组装,开发了白蛋白结合鼠尾草酸的纳米颗粒ABCA,作为ICB的再激活剂。体外实验中,ABCA有效抑制了Wnt/β-catenin级联反应,在促进细胞凋亡的同时抑制细胞增殖。最值得注意的是,ABCA通过重振T淋巴细胞介导的适应性免疫反应,恢复了免疫治疗耐药LUAD原位同种异体移植小鼠模型中,抗PD1的抗癌功效。此外,ABCA在治疗和高剂量毒性试验期间不良反应极小,具备临床转化潜力。总得来说,该研究为改善免疫疗法的耐药性提供了新视角,也为将Wnt抑制剂转化为临床免疫治疗药物提供了一条有效路径。
来源:iNature
-
生物医药领域要点速览

生物医药领域要点速览
-
Cell Res:把肝癌变成“慢病”!厦门大学林圣彩等团队发现“辟谷精”为肝癌治

Cell Res:把肝癌变成“慢病”!厦门大学林圣彩等团队发现“辟谷精”为肝癌治
-
Nature全新子刊—Nature Hearth,上线首篇论文!

Nature全新子刊—Nature Hearth,上线首篇论文!
-
《科学》:癌细胞喜欢“酸”的原因找到了!这种环境让肿瘤生长更猛烈!

《科学》:癌细胞喜欢“酸”的原因找到了!这种环境让肿瘤生长更猛烈!
-
CRM:这思路,绝了!中国医大/浙大/复旦团队,将中性粒细胞变成“顺风车”,搭载

CRM:这思路,绝了!中国医大/浙大/复旦团队,将中性粒细胞变成“顺风车”,搭载