干货分享 | 荧光原位杂交技术
荧光原位杂交技术(FISH)是一种利用荧光信号检测探针的原位杂交技术[1]。它将荧光信号的高灵敏度、安全性及直观性和原位杂交的高特异性结合起来,通过荧光标记的核酸探针与待测样本核酸进行原位杂交。在荧光显微镜下对荧光信号进行辨别和计数,从而对染色体或基因异常的细胞和组织样本进行检测和诊断,为各种基因相关疾病的分型、预前和预后提供准确的依据。FISH染色结果如图1.1所示。
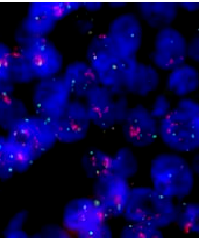
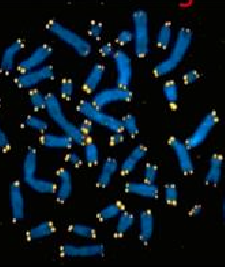
图1.1 FISH染色结果[2]
二.FISH的原理
FISH分为直接法和间接法。
直接法是在已知碱基序列的核酸探针上标记荧光素,在组织切片、间期细胞及染色体标本上与靶核酸进行原位杂交。因所形成的杂交体带有荧光素。故可在荧光显微镜下直接观察。
间接法使用非荧光物质标记的核酸探针。如生物素或地高辛等标记探针,再通过亲和连接或免疫反应带入荧光物质来检测杂交体的存在。
广义上讲,FISH靶序列可以是DNA或RNA,既可以用来进行基因组层面的研究,也可以进行表达层面的研究[1]。
目前常用的荧光素有异硫氰酸荧光素、得克萨斯红、罗丹明及其衍生物四甲基异硫氰酸罗丹明等[3]。
三.FISH的发展
荧光原位杂交技术是在同位素原位杂交技术的基础上发展起来的。1969年Gall和Pardue及John等分别独立建立了同位素原位杂交技术。1974年Evans第一次将染色体显带技术和原位杂交技术结合起来,提高了基因定位的准确性。1975年,Manning等人最先在溶液的分子杂交中,使用非放射性标记,通过细胞色素C将生物素与RNA分子连接起来。1977年Rudkin等发明了用间接免疫荧光法检测目的DNA的非同位素原位杂交技术。1981年Bauman首次报道了采用荧光素标记的探针在细胞制片上进行基因原位杂交,建立了非放射性原位杂交技术[4, 5]。
FISH技术发展至今已40多年,一直是细胞学研究的重要手段[6]。自1990年以来,FISH在方法上形成了从一种颜色到多种颜色、从中期染色体FISH到粗线染色体FISH再到纤维-FISH的发展趋势,并且随着物理、化学技术的发展与进步,免疫染色、量子点和微流控芯片等不断被引入到荧光原位杂交中,促进了荧光原位杂交技术和分子细胞遗传学的发展[7, 8]。
目前荧光原位杂交技术因其安全、准确、方便、实用等优点得到了广泛的关注及应用。
四.FISH的应用
0
1
荧光原位杂交技术在肿瘤诊断中的应用
肿瘤已经成为现代人类死亡的主要原因之一,肿瘤的提前确诊对治疗有着极大的帮助。过去诊断细胞样本中是否含有肿瘤细胞主要用巴氏染色法等一些细胞化学染色法。新涌现的辅助诊断技术相比过去的方法更快捷简单,荧光原位杂交技术就是其中之一[4]。

(1)血液肿瘤学
临床上对血液肿瘤的FISH检测主要集中在:染色体异位形成的融合基因的检测;基因缺失检测可以发现一些关键基因的缺失,有助于疾病的诊断及预后判断;使用荧光原位杂交技术可对微小残留病灶进行检测,以及进行造血干细胞移植状态的监测。
(2)实体肿瘤学
目前应用于临床的检测基因突变方法以NGS和PCR为主。与FISH相比,NGS对实验室要求高,同时存在检测周期长和检测费用高等问题;荧光PCR只能够通过标准曲线和标准品进行相对定量,无法做到绝对定量,数字PCR的检测系统成本高,通量有限,操作繁琐,也不能在细胞水平上观察到基因突变的状态,不具备定位的功能。FISH技术可以在间期细胞核上找到DNA扩增的直接证据,而且间期细胞核所显示出的扩增DNA荧光信号的数量多少及荧光强度常与DNA扩增的水平有关。
FISH被广泛应用于乳腺癌、膀胱癌,宫颈癌,肺癌和淋巴癌等实体肿瘤的辅助诊断。目前,FISH主要集中用于对肿瘤的早期诊断、疗效检测,个体化治疗和预后判断等方面[9]。
0
2
荧光原位杂交技术在基因定位中的应用
基因定位是荧光原位杂交的最基础最成功的应用。利用荧光原位杂交灵敏、准确,并且可以一次检测多段基因等特点,可以确定目标基因的准确位置,确定几个基因之间的位置关系,以及基因与染色体端粒之间的关系,基因与着丝点的关系,是构建基因图谱的基本要素。目前荧光原位杂交技术被广泛地应用于基因的物理定位及基因图谱的绘制[4]。
0
3
荧光原位杂交技术在产前检查中的应用
产前诊断是优生优育的重要保障。染色体异常是评价重大出生缺陷性疾病的重要指标。最常见的染色体异常是染色体数目异常,可能引发死胎、流产,即使存活也会使患病儿童畸形、生长缓慢、智力低下等。利用荧光原位杂交技术可以检测染色体非整倍体的特点,采集孕妇羊水,对未培养的羊水间期细胞进行检测,确定其是否为非整倍体,对胎儿染色体异常疾病进行诊断,使产前诊断时间缩短至24~48 h。荧光原位杂交的实验技术和探针的不断改进,应用荧光原位杂交方法进行产前诊断对一些重大染色体异常引起的疾病确诊率已经达到99%,相较于传统诊断方法更快捷,能够减少孕妇等待的痛苦[4]。
五.FISH诊断的优势
FISH诊断的优势主要体现在经济安全、检测速度快、操作简便、灵敏度高和特异性强等方面。
在非小细胞肺癌治疗中,靶向治疗是非常有效的一种新的治疗方法,提高了肿瘤的治愈率。其中,表皮生长因子受体(EGFR)作为非小细胞肺癌分子靶向治疗的靶标,酪氨酸激酶抑制剂能够对EGFR基因变异的癌细胞的生长进行抑制。所以,对EGFR基因突变进行检测非常重要,可以为非小细胞肺癌的治疗方案和预后判定提供重要信息[10]。
参考文献:
[1]. 荧光原位杂交技术-百度文库
[2]. 陈正启. 全自动荧光原位杂交系统装置的研究与开发[D].武汉纺织大学,2020.DOI:10.27698/d.cnki.gwhxj.2020.000048.
[3]. http://www.360doc.com/content/14/0915/15/5514788_409659718.shtml
[4]. 张淼,陈瑛,吴忆宁等.荧光原位杂交技术的应用进展[J].哈尔滨师范大学自然科学学报,2014,30(06):90-93.
[5]. 佘尚扬.荧光原位杂交技术的研究进展和应用[J].中国现代药物应用,2011,5(14):129-131.DOI:10.14164/j.cnki.cn11-5581/r.2011.14.018.
[6]. 姜春秀,姚伟,张木清等.新型寡聚核苷酸荧光原位杂交:发展与应用[J].植物遗传资源学报,2023,24(02):349-356.DOI:10.13430/j.cnki.jpgr.20220801001.
[7]. 何世斌,柴连琴,谭珺隽等.荧光原位杂交技术的研究进展[J].植物科学学报,2014,32(02):199-204.
[8]. 钱文丹,陈波利.荧光原位杂交技术及其应用[J].乡村科技,2018,No.193(25):51-52.DOI:10.19345/j.cnki.1674-7909.2018.25.030.
[9]. 温旺荣, 周华友主编,临床分子诊断学 第2版,广东科技出版社,2015.04,第72-75页
[10]. 侯舒倩.荧光原位杂交与免疫组化技术在非小细胞肺癌中的应用比较[J].黑龙江医学,2019,43(02):160-161+164.
来源:通灵生物
-
江西中医药大学/深圳市人民医院等联合发表14.6分Top期刊,揭示迷迭香酸通过调

江西中医药大学/深圳市人民医院等联合发表14.6分Top期刊,揭示迷迭香酸通过调
-
超详细教程:论文图片要求有哪些,图片配色怎么调

超详细教程:论文图片要求有哪些,图片配色怎么调
-
SCI投稿:全流程详细指南

SCI投稿:全流程详细指南
-
一年中SCI黄金投稿期,终于被我拿捏了!

一年中SCI黄金投稿期,终于被我拿捏了!
-
干货 || 活细胞表面抗原的荧光染色(间接免疫荧光)

干货 || 活细胞表面抗原的荧光染色(间接免疫荧光)