实验技术 | 如何做出更漂亮更准确的细胞周期检测数据
细胞周期(cell cycle)是指从一次细胞分裂形成子细胞开始到下一次细胞分裂形成子细胞为止所经历的过程。在这一过程中,细胞的遗传物质复制并均等地分配给两个子细胞。与前几期我们介绍过的克隆形成等实验一样,细胞周期也是评价细胞增殖功能的重要实验,可反映细胞增殖的速度。细胞周期主要分为分裂间期和分裂期(M期)2大过程。而分裂间期又分为三期、即DNA合成前期(G1期)、DNA合成期(S期)与DNA合成后期(G2期)。
1 G1期主要合成RNA和核糖体,细胞体积明显增大。
2 S期除了合成DNA外,还要合成组蛋白以及DNA复制所需的酶。
3 G2期是有丝分裂的准备期,DNA合成终止,大量合成RNA包括微管蛋白和促成熟因子等。
4 M期细胞分裂,DNA由二倍体重新成为一倍体。

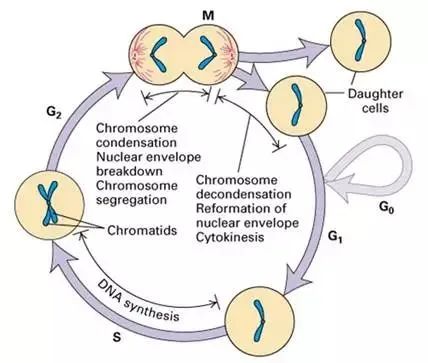
注:G0期是指某些细胞在分裂结束后会暂时离开细胞周期,停止细胞分裂;但在一定适宜刺激下,又可进入周期。(源自互联网)
分裂间期持续的时间远远比分裂期持续时间长,在一个正常细胞周期中,分裂间期时间会占整个细胞周期的90%~95%;
细胞周期研究的应用
细胞周期的研究对于深入了解生物的生长发育和控制肿瘤生长等有重要意义。细胞周期失调是癌症的主要特征之一。有资料表明肿瘤是一类细胞周期性疾病,因此在肿瘤生物学及肿瘤药理学领域对肿瘤细胞周期的分析对肿瘤生物学特征及肿瘤药物作用机制的研究具有重要的意义。
✔ 在肿瘤病理学研究中,通常以S期细胞比率作为判断肿瘤增殖状态的指标。
✔ 在肿瘤治疗中,G0期细胞对化疗不敏感,癌细胞难以被有效杀灭,往往成为日后癌症复发的根源。因而可通过调控机理的研究,诱发G0期癌细胞进入细胞周期,提高化疗敏感性,再合理用抗癌药物加以杀灭,是防止癌转移和扩散的重要调控措施。
因此对细胞周期调控的研究,有助于阐明肿瘤的发生以及终末细胞的分化,将为治疗肿瘤和诱导终末分化细胞的增殖提供有益的思路。
细胞周期的检测
测定细胞周期的方法很多,有同位素标记法、流式细胞仪法、基于细胞成像的荧光检测法、BrdU(5-溴脱氧尿嘧啶核苷)掺入法等。其中流式检测法因适用于大量样品检测,可快速分析单个细胞的多种特性,是目前最为常用的测定细胞周期的一种方法。下面详细介绍
检测原理:在细胞周期的不同时期,细胞核内的DNA含量存在差异。通常正常细胞的G1/G0期具有二倍体细胞的DNA含量(2N),而G2/M期具有四倍体细胞的DNA含量(4N),而S期的DNA含量介于二倍体和四倍体之间。
因此,在流式检测时,可以使用核酸染料染色后,通过检测荧光强度来判断细胞处于哪一时期。流式中常用碘化丙啶(Propidium,简称PI)与DNA结合,其荧光强度直接反映了细胞内DNA含量————DNA含量多,荧光强度高,DNA含量少,荧光强度低。
实验步骤
(1)细胞培养:取对数生长期的细胞,按1×106cells/ mL以1mL接种24孔板或2mL接种于6孔板内,进行所需的处理(比如加入药物),特定时间后终止培养,进行下一步的实验。Ps:建议选择6孔板操作,细胞给药密度在60%左右
(2)收集细胞:倒去培养基,用胰酶适度消化细胞,800rpm离心5min,收集细胞沉淀,弃去上清。
(3)细胞固定:用预冷PBS洗涤1-2次,吸净离心管残余的PBS后,加入300μL PBS重悬,将细胞吹散,避免细胞成团。随后将细胞悬液逐滴滴入-20℃ 预冷的75%乙醇,边加边高速搅拌,避免细胞粘连在一起,置于-20°C冰箱固定过夜。Ps:由于流式分析时需要的是单个细胞悬液,因此在操作过程中需充分混悬细胞;细胞固定后,不可过度吹打细胞,以防产生过多的细胞碎片。
(4)细胞染色:染色当天取出标本,800rpm离心5min,弃上清,以3mL的PBS洗涤1-2次,加入400μL溴化乙锭(PI,50μg/mL),100μl RNase A(100ug/mL),4℃避光孵育60min。Ps:弃去乙醇溶液此时格外需要注意的是,离心后细胞不是全部沉淀在管底,管壁上也会存在大量细胞,去上清一定要注意。
(5)流式分析:以标准程序用流式细胞仪检测,一般计数2~3万个细胞,结果用细胞周期拟和软件ModFit分析。Ps:上机前要以50μm尼龙网膜或35μm细胞过滤器过滤细胞!因为PI具有很强的粘附性,容易使细胞聚团!上机检测时,必须重悬成细胞悬液后再检测,否则容易堵仪器管道。
结果图解读
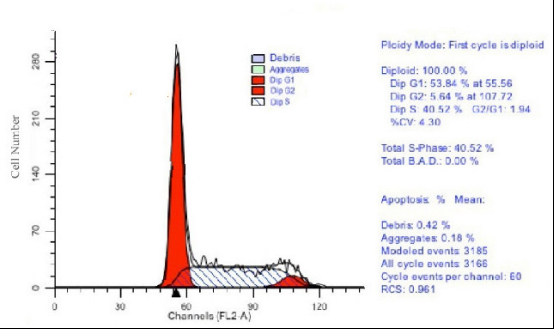
(1)纵坐标Cell Number:即计数的有效细胞数;
(2)横坐标DNAContent:即DNA含量;
(3)分析细胞周期的方法是依据细胞DNA含量(横坐标)来分析的:
G0/G1期:第一个峰。G1期是DNA含量最少的时期,DNA复制还没有开始;G0期是细胞静止期,不复制DNA,因此图上无法与G1期分开;
S期:第二个不高但很宽的峰。此时期细胞开始复制到完成复制,是一个一倍DNA到二倍DNA的过程;
G2/M期:第三个峰。G2期是DNA复制完成至分裂的一段时间,此时细胞内含二倍DNA;M期是细胞分裂的过程,此时细胞内是二倍DNA,无法与G2期分开。
(4)右侧数字含义
Dip G1-53.84% at 55.56,即G1期DNA含量平均值为55.56;53.84%即G1期细胞数占总数的53.84%;Dip G2-5.64% at 107.72,即G2期DNA含量平均值为107.72,5.64%即G2期细胞数占总数的5.64%;以此类推…
CV:变异系数(Coefficient of Variation)反映G0/G1峰分辨率和精确度,是评价周期结果好坏的一个重要指标。一般CV越小,峰形越好,越尖锐,质量越好;能控制在5%左右是比较好的结果,一般小于10%就被认可了。
Debris:表示细胞碎片,越少越好;
5、什么样的数据结果可以用?
✔ G2/M期细胞的DNA含量是G1期的2倍,在直方图上形成一个2倍于G1信号峰的高斯峰;
✔ CV(变异系数)表示峰的宽度,CV值越小,峰形越好,最好是在5%左右,一般小于10%也被认可。
✔ RCS最好是在1~3,高于5则不被认可。RCS高,说明数据的分布和软件所建立模型的预期值的差别比较大,可能由于处理细胞的时候RNA酶消化不好,或者是PI的浓度不佳造成的。
虽然此检测方法操作简便,仅需简单的固定染色即可进行检测,但很多同学做出来的结果还是不够理想。
常见问题
(1)CV值过大影响CV的因素主要包括两方面:仪器因素(如液流、光路、机器调试等)和样本制备及染色过程对标本的人为影响。在进行分析时应尽量减少这两大因素带来的变异。
CV值过大的异常原因及相应解决方案如下:

(2)G2/M期缺失
✔ 首先要确定我们所检测的细胞是能够进行分裂增殖的,如:外周血淋巴细胞在正常情况下基本都是不会进行增殖的,处于G0期。
✔ 此外,如果细胞培养条件不对或营养不足,引起细胞生长缓慢,也会导致大量细胞进入G0期。此时需及时优化培养条件,否则时间一长会引起细胞状态变差,直至细胞死亡。
✔ 还有就是,很多细胞生长密度过高,会出现接触抑制,同样会导致G2/M期缺失。所以,在进行细胞周期实验时,一定要保证检测时细胞尚有合理的生长空间。
实验要点/注意事项
下面小编带大家来看看细胞周期检测中的实验要点/注意事项,希望大家都能够做出理想的检测结果.
制备单细胞悬液:操作应轻柔,减少碎片,较多的碎片会干扰S 期的计算,也会妨碍分析较小的亚二倍体峰。大量的坏死或凋亡细胞也会带来过多碎片,在样品制备过程中应尽量避免。
利用RNase消除细胞周期检测中RNA的影响:PI是一种插入性核酸荧光染料,能选择性地嵌入核酸DNA双链螺旋的碱基之间并发出荧光,但也可以插RNA的双链区,非 DNA特异性,所以需加入RNase消除RNA的影响;
进行DNA染色时不要洗涤:不同于蛋白质染料和细胞之间的牢固结合,DNA与染料的结合,是一种结合态与游离态之间松散的平衡,洗涤步骤会造成染料丢失,降低核酸的特异性荧光,造成测量值降低;
最低速度上机检测:进样速度为低速,避免仪器把相邻细胞当作一个细胞。流速越高,CV值越大。若峰形较宽,可能就是进样速度太快。因此,进行DNA分析时,尽量采用最低流速10μL/min-12.5μL/min进行检测。
仪器质控定期做,尽可能排除因机器设置引起的峰形加宽;
在进行周期实验时,需采用PI-A + PI-H来排除粘连体:黏连体是指一起通过激光照射区而被错误地记录为一个细胞的两个细胞或颗粒。在DNA 分析中,两个具有2N DNA 含量的细胞同时通过激光照射区,即被记录成一个4N 的荧光信号,造成4N 的细胞增多的假象。胞黏连体过多会对分析结果造成影响,应在样本制备时尽量避免。在跑样过程中,需要对样本进行混匀,对于高通量进样来说,吹吸混匀的效果要好于振荡和搅拌混匀。
PI的坐标选线性:线性更能体现DNA含量的倍数关系。在DNA含量分析中,G2+M峰的数值应该是G0/G1峰的两倍。G0/G1峰和G2+M峰的位置提供了比较其他峰位置的基准。一般情况下,G2/M与G1的比值需介于1.95-2.05之间。
由于PI具有黏性,通常周期实验放在最后做,否则需要深度清洗后,再进行其他实验。
-
江西中医药大学/深圳市人民医院等联合发表14.6分Top期刊,揭示迷迭香酸通过调

江西中医药大学/深圳市人民医院等联合发表14.6分Top期刊,揭示迷迭香酸通过调
-
超详细教程:论文图片要求有哪些,图片配色怎么调

超详细教程:论文图片要求有哪些,图片配色怎么调
-
SCI投稿:全流程详细指南

SCI投稿:全流程详细指南
-
一年中SCI黄金投稿期,终于被我拿捏了!

一年中SCI黄金投稿期,终于被我拿捏了!
-
干货 || 活细胞表面抗原的荧光染色(间接免疫荧光)

干货 || 活细胞表面抗原的荧光染色(间接免疫荧光)