肿瘤免疫 | 南方医科大学石敏/廖旺军发现烟酰胺代谢在巨噬细胞与成纤维细胞之间的对抗调控胃癌微环境
免疫检查点阻断导致晚期胃癌治疗取得突破。然而,胃癌中突出的异质性,特别是肿瘤微环境的异质性,强调了抗肿瘤反应是多因子相互作用的反映。
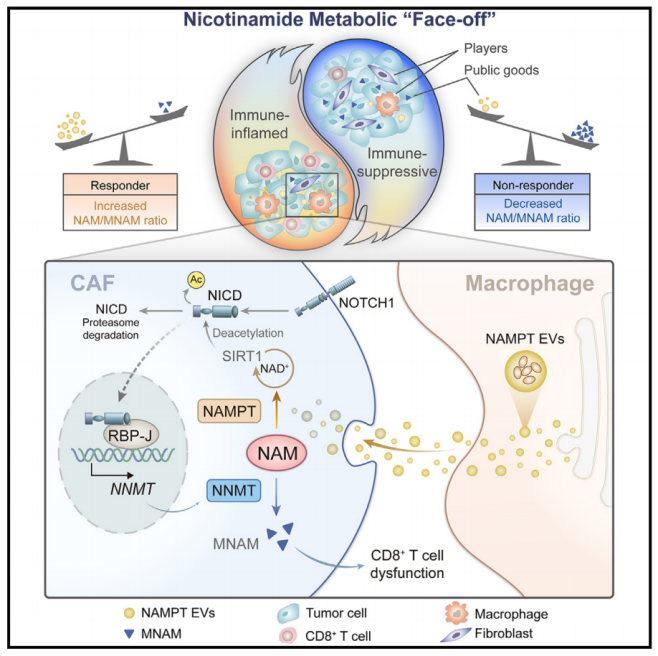
2024年6月18日,南方医科大学石敏及廖旺军共同通讯在Cell Metabolism在线发表题为“Nicotinamide metabolism face-off between macrophages and fibroblasts manipulates the microenvironment in gastric cancer”的研究论文,该研究通过转录组学分析和动态血浆样本分析,确定了肿瘤微环境中的代谢“对抗”机制,如烟酰胺代谢的双重预后意义。具体来说,巨噬细胞和成纤维细胞分别表达限速酶烟酰胺磷酸核糖基转移酶和烟酰胺N-甲基转移酶,调节烟酰胺/1-甲基烟酰胺比例和CD8+ T细胞功能。
机制上,烟酰胺N-甲基转移酶被NOTCH通路转录因子RBP-J转录激活,并通过SIRT1/NICD轴被含有烟酰胺磷酸化核糖基转移酶的巨噬细胞来源的细胞外囊泡进一步抑制。通过自体注射细胞外囊泡调控烟酰胺代谢可恢复胃癌CD8+ T细胞的细胞毒性和抗PD-1反应。总的来说,该研究强调了NAM代谢作为ICB的生物标志物,并为GC- TME的内在代谢串扰提供了见解。

胃癌(GC)具有独特的异质性肿瘤微环境(TME)。尽管免疫检查点阻断(ICB)的应用提高了胃癌的生存率,但近一半的胃癌患者对ICB治疗没有反应。之前的研究表明,TMEscore表征TME免疫浸润模式,比单独表达PD-L1更准确地识别将受益于ICB的GC患者。这一观察结果表明,对ICB的反应实际上是TME复杂相互作用的结果。为了描述这些相互作用,应该考虑两个主要因素。首先,“玩家”(细胞)导致TME的重塑。细胞的不同重编程和功能需求触发并推动它们的动态相互作用,其特点是抗肿瘤和肿瘤功能之间的微妙平衡CD8+ T细胞和自然杀伤细胞是抗肿瘤反应的效应细胞。相比之下,M2型巨噬细胞、髓源性抑制细胞(MDSCs)和癌症相关成纤维细胞(CAFs)在产生免疫抑制TME中起主要作用。这些细胞在TME中的主动对话导致竞争以满足各自的功能需求。关注参与串扰的主要细胞主角可能有助于阐明TME的复杂性,并确定扭转不良反应的目标。
-
生物医药领域要点速览

生物医药领域要点速览
-
Cell Res:把肝癌变成“慢病”!厦门大学林圣彩等团队发现“辟谷精”为肝癌治

Cell Res:把肝癌变成“慢病”!厦门大学林圣彩等团队发现“辟谷精”为肝癌治
-
Nature全新子刊—Nature Hearth,上线首篇论文!

Nature全新子刊—Nature Hearth,上线首篇论文!
-
《科学》:癌细胞喜欢“酸”的原因找到了!这种环境让肿瘤生长更猛烈!

《科学》:癌细胞喜欢“酸”的原因找到了!这种环境让肿瘤生长更猛烈!
-
CRM:这思路,绝了!中国医大/浙大/复旦团队,将中性粒细胞变成“顺风车”,搭载

CRM:这思路,绝了!中国医大/浙大/复旦团队,将中性粒细胞变成“顺风车”,搭载