常规PCR实验步骤
PCR技术通过精准扩增DNA片段,在基因克隆和病原体诊断中发挥关键作用。掌握引物设计、反应体系优化和防污染措施,是获得高特异性产物的核心。
内容由AI智能生成
有用
PCR(聚合酶链式反应,Polymerase Chain Reaction)是一种用于扩增特定DNA片段的技术,广泛应用于基因克隆、突变检测、病原体诊断等领域。以下是 常规PCR实验步骤 及关键注意事项:
一、实验准备
1.试剂
DNA模板(基因组DNA、cDNA或质粒)
特异性引物(上游和下游引物,通常18-25bp)
dNTPs(dATP、dTTP、dCTP、dGTP)
Taq DNA聚合酶(或其他高保真酶)
PCR缓冲液(含Mg²⁺)
无菌ddH₂O
2.仪器
PCR仪(热循环仪)
离心机、冰盒、微量移液器及无菌PCR管
二、PCR实验步骤
1. 反应体系配制(以25μL体系为例)
在冰上按以下顺序加入试剂(减少非特异性扩增):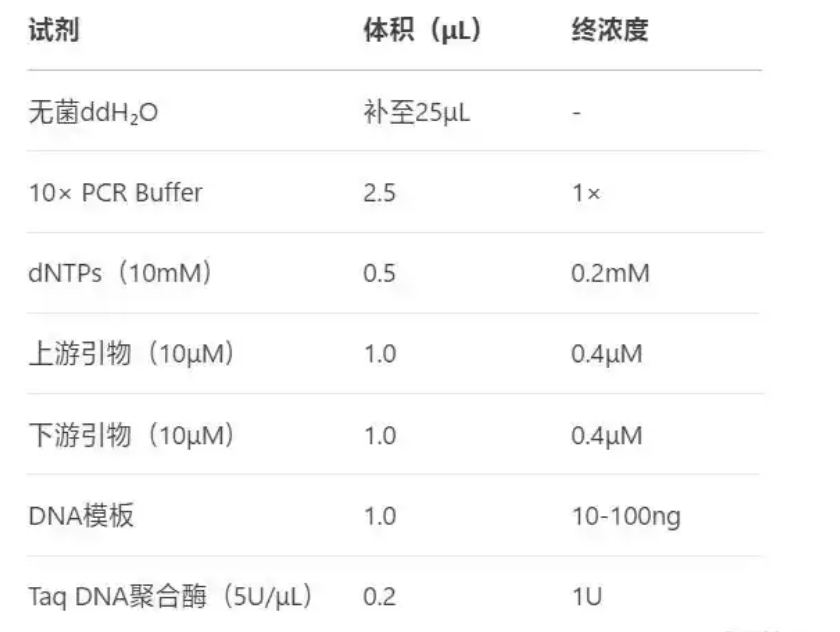
注意:引物浓度需优化(通常0.1-1μM)、模板量过高可能导致非特异扩增。
2. 混匀与离心
轻轻吹打混匀,短暂离心使液体沉至管底。
若使用热启动酶,需在高温步骤后加酶。
3. PCR扩增程序
根据引物Tm值和产物长度设置程序(示例):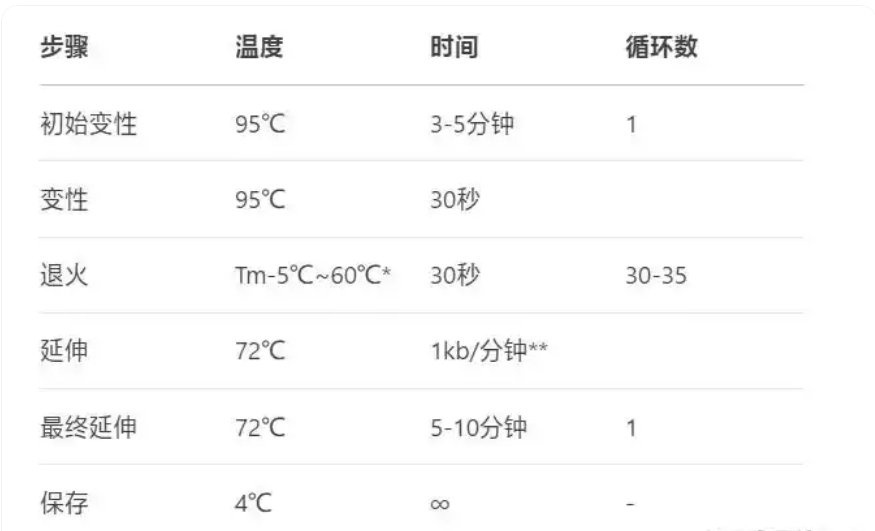
注:退火温度:一般为引物Tm值减5℃(需优化)、延伸时间:按扩增片段长度调整(如1kb片段需1分钟)。
4. 产物检测
琼脂糖凝胶电泳:
配制1-2%琼脂糖凝胶(含核酸染料如GelRed)。
取5μL PCR产物 + 1μL 上样缓冲液,点样。
电泳(100-120V,20-30分钟),紫外灯下观察条带。
三、关键注意事项
防污染:
使用无菌PCR管和枪头,操作区与模板制备区分开。
设阴性对照(无模板对照,NTC)排除污染。
引物设计:
避免引物二聚体或二级结构(可用Primer-BLAST检查)。
Tm值上下游引物差异≤5℃。
优化条件:
退火温度:梯度PCR筛选最佳温度。
Mg²⁺浓度:影响酶活性(通常1.5-2.5mM)。
常见问题:
无条带:检查模板质量、引物特异性或反应条件。
非特异条带:提高退火温度、减少循环数或优化Mg²⁺浓度。
四、特殊PCR类型
逆转录PCR(RT-PCR):需先以RNA为模板,通过逆转录酶合成cDNA。
实时荧光定量PCR(qPCR):加入荧光探针或染料,实时监测扩增。
巢式PCR:两轮PCR提高特异性(第一轮扩增大片段,第二轮用内侧引物)。
五、示例引物设计参数
长度:18-25bp
GC含量:40-60%
Tm值:55-65℃(上下游引物接近)
避免:3'端连续G/C(易引发非特异结合)。
通过优化反应体系和条件,可获得高特异性、高产量的PCR产物。
免责声明:本文内容仅供读者学习和交流。文章、图片等版权归原作者享有,如有侵权,请留言联系!
-
江西中医药大学/深圳市人民医院等联合发表14.6分Top期刊,揭示迷迭香酸通过调

江西中医药大学/深圳市人民医院等联合发表14.6分Top期刊,揭示迷迭香酸通过调
-
超详细教程:论文图片要求有哪些,图片配色怎么调

超详细教程:论文图片要求有哪些,图片配色怎么调
-
SCI投稿:全流程详细指南

SCI投稿:全流程详细指南
-
一年中SCI黄金投稿期,终于被我拿捏了!

一年中SCI黄金投稿期,终于被我拿捏了!
-
干货 || 活细胞表面抗原的荧光染色(间接免疫荧光)

干货 || 活细胞表面抗原的荧光染色(间接免疫荧光)