130 种实验室常用试剂配制方法 (附全套资料)
实验人集合!还在为翻箱倒柜找配方抓狂?别慌,实验菌把实验室常用试剂配制方法一次打包:高频试剂、生化试剂、培养基、缓冲液……一本查全,随用随配,省钱省时!让试剂不再成为实验绊脚石。(文末领取全套 PDF)
、高频试剂配制方法
1、1 M Tris-HCl
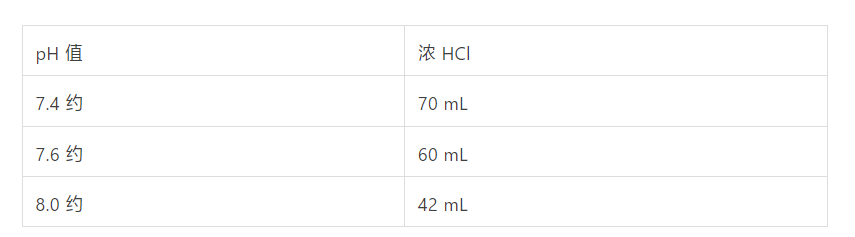
组分浓度 1 M Tris-HCl (pH 7.4,7.6,8.0),配制量 1,配置方法:
称量 121.1 g Tris 置于 1 L 烧杯中。
加入约 800 mL 的去离子水,充分搅拌溶解。
按下表量加入浓盐酸调节所需要的 pH 值。
将溶解定容至 1 L。
高温高压灭菌后,室温保存。
注意:应使溶液冷却至室温后再调定 pH 值,因为 Tris 溶液的 pH 值随温度的变化差很大,温度每升高 1℃,溶液的 pH 值大约降低 0.03 个单位。
2、1.5 M Tris-HCl
组分浓度 1.5 M Tris-HCl (pH 8.8),配制量 1 L ,配置方法:
称取 181.7g Tris 置于 1 L 烧杯中。
加入约 800 mL 的去离子水,充分搅拌溶解。
用浓盐酸调 pH 值至 8.8。
将溶液定容至 1 L。
高温高压灭菌后,室温保存。
注意:应使溶液冷却至室温后再调定 pH 值,因为 Tris 溶液的 pH 值随温度的变化差异很大,温度每升高 1℃,溶液的 pH 值大约降低 0.03 个单位。
3、10×TE Buffer
组分浓度 100 mM Tris-HCl,10 mM EDTA (pH 7.4,7.6,8.0),配制量 1 L ,配置方法:
量取下列溶液,置于 1 L 烧杯中。
1 M Tris-HCl Buffer(pH 7.4,7.6,8.0) 100 mL
500 mM EDTA(pH 8.0) 20 mL
向烧杯中加入约 800 mL 的去离子水,均匀混合。
将溶液定至 1 L 后,高温高压灭菌。
室温保存。
4、3 M 醋酸钠
组分浓度 3 M 醋酸钠(pH 5.2),配制量 100 mL ,配置方法:
称取 40.8 g NaOAc•3H2O 置于 100~200 mL 烧杯中,加入约 40 mL 的去离子水搅拌溶解。
加入冰乙酸调节 pH 值至 5.2。
加入去离子水将溶液定容至 100 mL。
高温高压灭菌后,室温保存。
5、PBS Buffer
组分浓度 137 mM NaCl,2.7 mM KCl,10 mM Na2HPO4,2 mM KH2PO4 ,配制量 1 L ,配置方法:
称量下列试剂,置于 1 L 烧杯中。
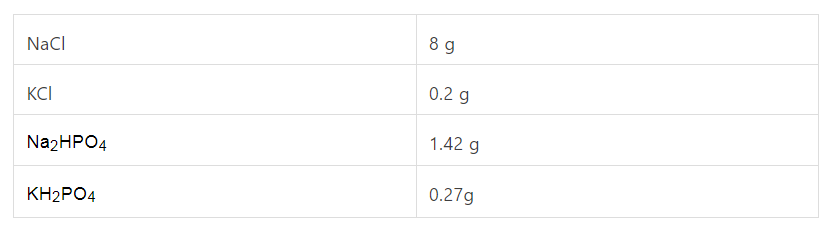
向烧杯中加入约 800 mL 的去离子水,充分搅拌溶解。
滴加 HCl 将 pH 值调节至 7.4,然后加入去离子水将溶液定容至 1 L。
高温高压灭菌后,室温保存。
注意:上述 PBS Buffer 中无二价阳离子,如需要,可在配方中补充 1mM CaCl2 和 0.5 mM MgCl2。
6、10 M 醋酸铵
组分浓度 10 M 醋酸铵,配制量 100 mL ,配置方法:
1.称量 77.1 g 醋酸铵置于 100~200 mL 烧杯中,加入约 30 mL 的去离子水搅拌溶解。
2.加去离子水将溶液定容至 100 mL。
3.使用 0.22 μm 滤膜过滤除菌。
4.密封瓶口于室温保存。
注意:醋酸铵受热易分解,所以不能高温高压灭菌。
7、Tris- HCl 平衡苯酚
配置方法
使用原料:大多数市售液化苯酚是清亮无色的,无需重蒸馏便可用于分子生物学实验。但有些液化苯酚呈粉红色或黄色,应避免使用。同时也应避免使用结晶苯酚,结晶苯酚必须在 160℃ 对其进行重蒸馏除去诸如醌等氧化产物,这些氧化产物可引起磷酸二酯键的断裂或导致 RNA 和 DNA 的交联等。因此,苯酚的质量对 DNA、RNA 的提取极为重要,我们推荐使用高质量的苯酚进行分子生物学实验。
操作注意:苯酚腐蚀性极强,并可引起严重灼伤,操作时应戴手套及防护镜等。所有操作均应在通风橱中进行,与苯酚接触过的皮肤部位应用大量水清洗,并用肥皂和水洗涤,忌用乙醇。
苯酚平衡:因为在酸性 pH 条件下 DNA 分配于有机相,因此使用苯酚前必须对苯酚进行平衡使其 pH 值达到 7.8 以上,苯酚平衡操作方法如下:
①液化苯酚应贮存于 -20℃,此时的苯酚呈现结晶状态。从冰柜中取出的苯酚首先在室温下放置使其达到室温,然后在 68℃ 水浴中使苯酚充分溶解。
②加入羟基喹啉(8-Quinolinol)至终浓度 0.1%。该化合物是一种还原剂、RNA 酶的不完全抑制剂及金属离子的弱螯合剂,同时因其呈黄色。有助于方便识别有机相。
③加入等体积的 1M Tris-HCl(pH 8.0),使用磁力搅拌器搅拌 15 分钟,静置使其充分分层后,除去上层水相。
④重复操作步骤③。
⑤加入等体积的 0.1 M Tris-HCl(pH 8.0),使用磁力搅拌器搅拌 15 分钟,静置使其充分分层后,除去上层水相。
⑥重复操作步骤⑤,稍微残留部分上层水相。
⑦使用 pH 试纸确认有机相的 pH 值大于 7.8。
⑧ 将苯酚置于棕色玻璃瓶中 4℃ 避光保存。
8、苯酚/氯仿/异戊醇
配置方法
说明:从核酸样品中除去蛋白质时常常使用苯/酚/氯仿/异戊醇(25:24:1)。氯仿可使蛋白(25 :24 :1) 质变性并有助于液相与有机相的分离,而异戊醇则有助于消除抽提过程中出现的气泡。
配置方法:将 Tris-HCl 平衡苯酚与等体积的氯仿/异戊醇(24:1)均匀混合后,移入棕色玻璃瓶中 4℃ 保存。
9、10%(W/V)SDS
组份浓度 10%(W/V)SDS ,配制量 100mL ,配置方法:
1.称量 10 g 高纯度的 SDS 置于 100~200 mL 烧杯中,加入约 80 mL 的去离子水,68℃ 加热溶解。
滴加数滴浓盐酸调节 pH 值至 7.2。
将溶液定容至 100 mL 后,室温保存。
10、2 N NaOH
组份浓度 2 N NaOH ,配制量 100 mL ,配置方法:
量取 80 mL 去离子水置于 100~200 mL 塑料烧杯中(NaOH 溶解过程中大量放热,有可能使玻璃烧杯炸裂)。
称取 8 g NaOH 小心地逐渐加入到烧杯中,边加边搅拌。
待 NaOH 完全溶解后,用去离子水将溶液体积定容至 100 mL。
将溶液转移至塑料容器中后,室温保存。
免责声明:本文内容仅供读者学习和交流。文章、图片等版权归原作者享有,如有侵权,请留言联系,文章来源于丁香实验。
-
江西中医药大学/深圳市人民医院等联合发表14.6分Top期刊,揭示迷迭香酸通过调

江西中医药大学/深圳市人民医院等联合发表14.6分Top期刊,揭示迷迭香酸通过调
-
超详细教程:论文图片要求有哪些,图片配色怎么调

超详细教程:论文图片要求有哪些,图片配色怎么调
-
SCI投稿:全流程详细指南

SCI投稿:全流程详细指南
-
一年中SCI黄金投稿期,终于被我拿捏了!

一年中SCI黄金投稿期,终于被我拿捏了!
-
干货 || 活细胞表面抗原的荧光染色(间接免疫荧光)

干货 || 活细胞表面抗原的荧光染色(间接免疫荧光)