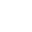上海交通大学最新 Science!颠覆传统认知
脂肪组织作为能量代谢的核心调节器官,其功能异常与肥胖、2 型糖尿病等一系列代谢性疾病密切相关。当前,全球肥胖率已突破 13%,而中国成人超重和肥胖人数超过 6 亿。肥胖所带来的健康威胁不容忽视 —— 肥胖人群非酒精性脂肪肝、心血管疾病的死亡率相比正常体重人群上升 30%–50%,每年消耗的医疗资源规模超过千亿元。尽管肥胖问题日益严峻,科学界对脂肪组织内常驻巨噬细胞的亚型分类及其与脂肪干细胞之间的相互作用机制,仍存在许多未解之谜。
上海交通大学医学院 Svetoslav Chakarov 教授团队长期致力于组织驻留巨噬细胞的空间特异性功能研究。早在 2019 年,该团队就在 Science 发表论文,揭示不同组织中间质巨噬细胞的分区特性 [1]。而他们最新的研究进一步聚焦于脂肪组织,首次阐明巨噬细胞如何调控脂肪干细胞命运,为代谢疾病的机制研究与治疗策略带来全新突破。
2025 年 8 月 28 日,Science 再次刊登了来自上海交通大学医学院免疫学研究所 Svetoslav Chakarov 团队的重要成果 [2]。该研究首次发现,白色脂肪组织(WAT)的小叶隔膜内存在一类稀有的巨噬细胞亚群—— CD209b⁺ LYVE1⁺ 隔膜巨噬细胞(sATMs),它们通过 TGFβ1(转化生长因子 β1)信号通路直接调控脂肪干细胞(ASCs)的分化方向。
图 1:文章来源(图源:[2]
脂肪中的巨噬细胞是否具备明确的分工?为回答这一问题,研究团队运用单细胞测序和免疫荧光等技术,对小鼠脂肪组织中的巨噬细胞进行了系统性的「身份鉴定」。结果出乎意料:这些细胞并非随机分布,而是按空间位置划分为三支功能迥异的群体。
第一支被称为「间隔守卫队」(septal ATMs,sATMs),它们特异性表达 CD209b⁺LYVE1⁺ 分子标记,驻扎于脂肪小叶之间的间隔区(septum)。该区域富含胶原和透明质酸,并且 sATMs 与表达 CD26 的脂肪干细胞(CD26⁺ ASCs)紧密相邻,仿佛共同维护一个微环境的代谢平衡。值得注意的是,sATMs 是一群在胚胎时期就已定居的「老居民」,寿命长、稳定性高,不依赖血液单核细胞的补充。
另外两支巨噬细胞群体也各有据点:「包膜守卫队」(capsular ATMs,cATMs)带有 LYVE1⁺CD209b⁻ 表型,位于脂肪组织外层包膜区;而「实质巡逻队」(parenchymal ATMs,pATMs)则为 LYVE1⁻CD209b⁻MHCIIʰⁱ,散布于脂肪细胞间的实质区,执行类似巡逻的功能。
研究还发现,在高脂饮食(HFD)诱导的代谢压力下,「实质巡逻队」会大规模扩增 —— 数量上升 2–3 倍,一半来自自身增殖,另一半则由单核细胞补充而来。相比之下,「间隔守卫队」sATMs 却数量稳定、位置不变,显示出其在代谢应激中的「稳定器」作用,提示它们可能具有更深刻的调控功能。
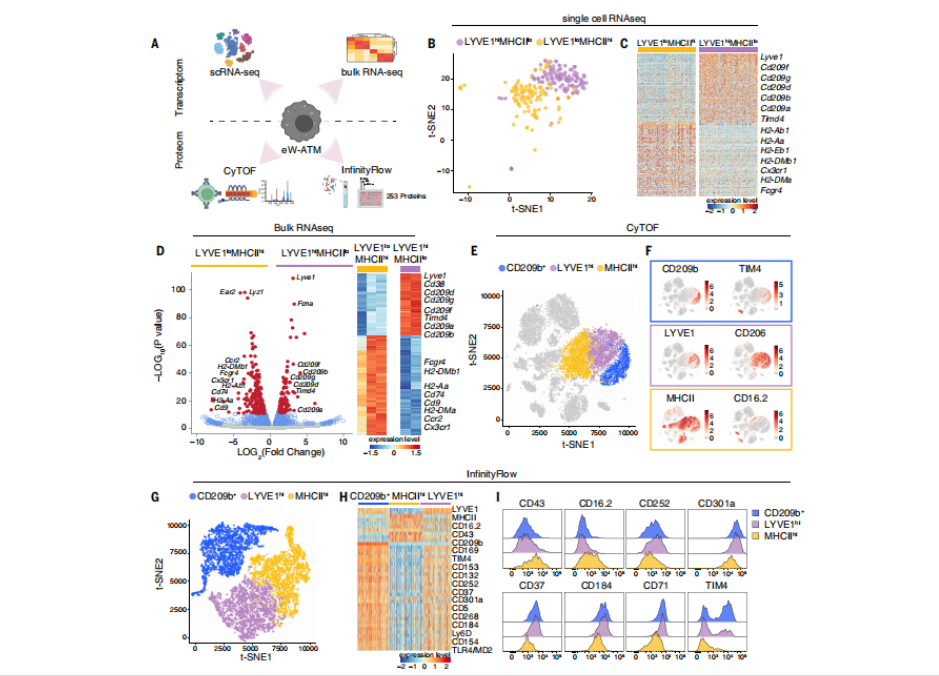
图 2 小鼠白色脂肪组织中三种表型不同的巨噬细胞群的鉴定(图源:[2])
那么 sATMs 究竟如何影响代谢?团队通过两类实验给出了令人振奋的答案:靶向清除 sATMs 或阻断其分泌的 TGFβ1,能够显著缓解肥胖引起的代谢异常。
在第一组实验中,研究者使用 Cd209bⁿˣᵈ/ᴰᵀᴿ 小鼠模型,通过白喉毒素(DTx)特异性清除 sATMs。结果发现,即使给予高脂饮食,这些小鼠体重增长也比对照组减少 40%,糖耐量提升 35%,胰岛素敏感性提高 28%,肝脏脂肪堆积甚至降低 50%。值得注意的是,这些代谢改善并不依赖于进食量的改变,而是源于脂肪组织自身功能的提升。
更令人惊喜的是,清除 sATMs 后,白色脂肪组织中出现了「产热转型」:UCP1⁺ 产热细胞面积增加 60%,氧气消耗率提高 25%,小鼠核心体温上升 0.8–1.2℃—— 相当于为脂肪安装了一套「能量燃烧装置」,将多余热量主动消耗。
第二组实验进一步揭示 sATMs 的作用机制:它们通过分泌 TGFβ1,作用于 ASC^CD26⁺ 细胞表面的受体,迫使干细胞朝储能的白色脂肪细胞分化,同时抑制其向耗能的褐/米色脂肪细胞转变。为验证该机制,团队构建了在 LYVE1⁺ 或 TIM4⁺ 巨噬细胞中特异性敲除 TGFβ1 的小鼠模型,结果与清除 sATMs 一致:体重控制更好、胰岛素敏感性上升、脂肪产热增强。这表明,sATM 来源的 TGFβ1 无疑是脂肪代谢调控的一个「核心开关」—— 中断该信号,就能促使脂肪从储热向产热转变,为肥胖及代谢疾病治疗开辟了新路径。
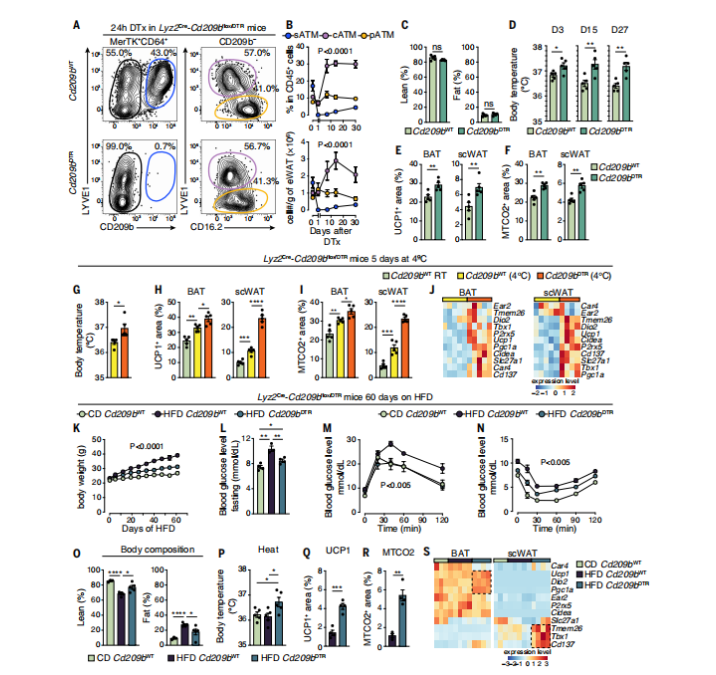
图 3 减少间隔 ATMs 可促进脂肪组织增强产热(图源:[2])
该研究打破了传统认知,强调巨噬细胞功能与其空间定位密切相关,更新了人们对其仅参与炎症反应的旧有观点。所发现的「sATM–TGFβ1–ASC」调控轴,为肥胖与 2 型糖尿病提供了精准靶点,可通过调节脂肪干细胞分化方向促使脂肪产热,同时规避传统抗炎治疗的副作用。此外,该机制在人类脂肪组织中同样保守,为小分子药物与细胞疗法的开发奠定了坚实基础,具备较高的临床转化前景。
尽管如此,从实验室到临床仍面临三大挑战:首先,需明确 sATMs 在棕色脂肪中是否存在及是否功能一致,防止治疗策略「一刀切」;其次,长期阻断 TGFβ1 可能带来脂肪纤维化或免疫紊乱等风险,需通过超过 1 年的动物实验验证其安全性;最后,应探索非药物干预手段 —— 如肠道菌群、特定膳食成分是否可调节 sATMs 的 TGFβ1 分泌,以期发展更温和、易推广的代谢管理策略,最终让患者受益。
免责声明:本文内容仅供读者学习和交流。文章、图片等版权归原作者享有,如有侵权,请留言联系。
-
江西中医药大学/深圳市人民医院等联合发表14.6分Top期刊,揭示迷迭香酸通过调

江西中医药大学/深圳市人民医院等联合发表14.6分Top期刊,揭示迷迭香酸通过调
-
超详细教程:论文图片要求有哪些,图片配色怎么调

超详细教程:论文图片要求有哪些,图片配色怎么调
-
SCI投稿:全流程详细指南

SCI投稿:全流程详细指南
-
一年中SCI黄金投稿期,终于被我拿捏了!

一年中SCI黄金投稿期,终于被我拿捏了!
-
干货 || 活细胞表面抗原的荧光染色(间接免疫荧光)

干货 || 活细胞表面抗原的荧光染色(间接免疫荧光)